(1)二酸化炭素
(2)ウ
(3)CaCO3+2HCl→CO2+H2O+CaCl2
|
質量保存の法則を確認する実験ですね。二酸化炭素の発生方法でもあります。
(1)
二酸化炭素の発生方法として1年生で習っていますね。
物質名で答えるので、「CO2」や「炭酸ガス」などは不可です。
参考ページ…気体>気体の発生方法
(2)
びんは密閉されているので、発生した気体は逃げることができません。
化学変化の前後で全体の質量は変わらないので、「変化しない(ウ)」となります。
参考ページ…化学変化と物質の質量>質量保存の法則
(3)
化学変化のようすを物質名で表すと、
炭酸カルシウム+塩化水素→二酸化炭素+水+塩化カルシウム
となります。それぞれの物質名を化学式に置き換えて、
_CaCO3+_HCl→_CO2+_H2O+_CaCl2
→の両辺でCa・C・O・H・Clの数を同じにします。
Ca…両辺とも1個なのでこのまま
C…両辺とも1個なのでこのまま
O…両辺とも3個なのでこのまま
H…左辺1個・右辺2個なので、左辺のHClを2個にする
Cl…左辺のHClを2個にすると、両辺とも2個になるので、これでOK
よって、 CaCO3+2HCl→CO2+H2O+CaCl2
参考ページ…化学反応式>化学反応式のつくり方 気体>気体に関する化学変化(参考)
(1)H2
(2)440cm3
(3)66cm3
(4)60cm3
(5)7cm3
|
水素の発生方法ですね。塩酸の濃度が一定なら、マグネシウムの質量によって、反応できる塩酸の体積は決まっています。
参考ページ…化学変化と物質の質量>気体・水溶液の体積と質量
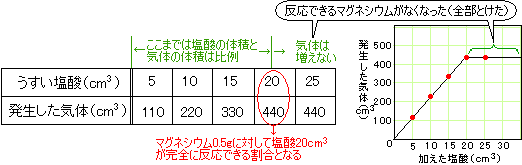
よって、マグネシウムの質量:塩酸の体積:発生する水素の体積=0.5(g):20(cm3):440(cm3)
を以下の解答で使っていきます。
(1)
水素の発生です。化学式で答えるので、H2ですね。
参考ページ…気体>気体の発生方法 原子記号と化学式>化学式
(2)
塩酸の体積が20cm3以上は、もう反応できるマグネシウムがないので、気体の発生は塩酸20cm3でストップします。
塩酸を30cm3加えても、20cm3ぶんしか反応できず、気体の発生も440cm3までということですね。
(3)
塩酸が3cm3なら、それに対応するマグネシウムは反応できますね。
塩酸の体積:水素の体積=20(cm3):440(cm3)=1:22 より、
塩酸1cm3に対して22cm3の水素が発生します。
塩酸が3cm3なら、22(cm3)×3=66(cm3)の水素が発生することになります。
(4)
マグネシウム0.5gに対し、20cm3までの塩酸が反応できました。
1.5gは0.5gの3倍なので、マグネシウムの質量が3倍になれば、反応できる塩酸の体積も3倍になります。
20(cm3)×3=60(cm3)
(5)
塩酸の体積:水素の体積=20(cm3):440(cm3)=1:22 を使いましょう。
154cm3の水素を発生させるのに必要な塩酸をχcm3として、
塩酸:水素=1:22=χ(cm3):154(cm3)
これを書き換えて 22×χ=154 よってχ=7(cm3)
参考ページ…比例式の解き方
マグネシウムの質量が変わっても、反応できる塩酸の体積の限度が変わるだけで、発生する水素の体積は塩酸の体積に比例するとしてしまっていいです。
ただし、反応できる上限だけは確認しておきましょう。
マグネシウム0.5gに対して塩酸20cm3なので、
マグネシウム0.1gに対しては20(cm3)÷5=4(cm3)の塩酸が反応できます。
マグネシウム0.2gに対しては4(cm3)×2=8(cm3)の塩酸が反応できます。
(3)で求めたように、塩酸1cm3に対して22cm3の水素が発生するので、
塩酸8cm3なら22(cm3)×8=176(cm3)の水素が発生します。
問題の154cm3はこれより少ないので、マグネシウムは十分あった、と判断できます。
|
うすい硫酸(酸性)と水酸化バリウム水溶液(アルカリ性)の
中和反応です。
中和すると硫酸バリウムという水にとけにくい塩(えん)が沈殿します。
硫酸+水酸化バリウム→水+硫酸バリウム
参考ページ…水溶液>中和
この場合も水溶液の濃度が一定なら、完全に反応できる
うすい硫酸の体積と水酸化バリウム水溶液の体積とできた沈殿
(硫酸バリウム)の質量の比は決まっています。
参考ページ
化学変化と物質の質量>気体・水溶液の体積と質量
|
 |
(1)
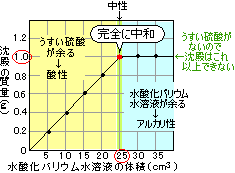
うすい硫酸に水酸化バリウム水溶液を加えていくと、加えた水酸化バリウム水溶液の体積に応じて中和し、沈殿ができていきます。
完全な中和点は、それ以上塩(沈殿…硫酸バリウム)が増えなくなったときを読みます。
ちょうど水酸化バリウム水溶液が25cm3のときから沈殿の量が変化しなくなっていますね。
うすい硫酸が全部使い果たされたのです。
(2)
沈殿の質量が0.6gというと、水酸化バリウム水溶液を15cm3加えたあたりです。
このへんはまだ、加えた水酸化バリウム水溶液の体積に比例して順調に沈殿の質量が増えているときなので、
水酸化バリウム水溶液が全部使われ、うすい硫酸が余っている状態ですね。
うすい硫酸の性質が出るので、酸性です。
(3)
うすい硫酸の量が足りなかったため、沈殿は1.0gより増えませんでしたが、
うすい硫酸の量を2倍にし、水酸化バリウム水溶液も十分あれば、沈殿も2.0gまで生成することになります。
グラフの比例の部分が水酸化バリウム50cm3(25cm3×2)まで続くことになりますね。
水酸化バリウム水溶液の体積:沈殿の質量=25(cm3):1.0(g)なので、
1.2gの沈殿をつくる水酸化バリウム水溶液の体積をχcm3として、
水酸化バリウム水溶液:沈殿=25(cm3):1.0(g)=χ(cm3):1.2(g)
これを書き換えて χ=25×1.2 よってχ=30(cm3)
参考ページ…比例式の解き方

