問題の中には、その化学変化にかかわった物質の質量だけでなく、水溶液の体積や発生した気体の体積との関係を問われることも多いですね。
反応する物質の質量の割合は決まっていますが、質量ではなく、体積がからんだときの考え方のテクニックをつかみましょう。
水溶液の体積と溶質の質量
たとえば固体と水溶液の反応の場合、実際に化学変化を起こすのは溶媒の水ではなく、中にとけている溶質です。
溶質の質量だけが化学変化に関係し、質量保存の法則や定比例の法則が成り立ちます。
※溶質・溶媒についてはこちらで復習してください。
|
その体積の水溶液にふくまれる溶質の量(質量)に注目する
|
濃度が一定の場合
問題文では「ある濃度の〜」というように、水溶液の濃度を変えずに体積だけを変化させていることがあります。
この場合、難しく考えることはありません。
濃度が一定なら水溶液の体積はそのまま質量扱いして比例式をつくります。
濃度が一定なら、中の溶質の質量は水溶液の体積に比例するからですね。
同じ濃度の水溶液の場合、体積が2倍になれば、中の溶質の質量も2倍になるということです。
|
【例題6】マグネシウム1.0gに対してある濃度の塩酸40cm3が過不足なく反応する。
マグネシウム2.5gに対して過不足なく反応できる同じ濃度の塩酸の体積を求めよ。
|
水素が発生する化学変化ですね。
マグネシウム1.0gに対してその塩酸40cm3反応できるので、
マグネシウム:塩酸=1.0g:40cm3 の割合で反応することがわかります。
2.5gのマグネシウムと反応できる塩酸をχcm3として、比例式をつくります。
マグネシウム:塩酸=2.5g:χcm3=1.0g:40cm3 比例式の解き方はこちら
これを書き直して1.0×χ=2.5×40 よって、χ=100(cm3)
濃度を変えた場合
この場合はちょっとアタマをつかいましょう。中の溶質の量(質量)に注目します。
たとえば水溶液を倍にうすめた場合は…
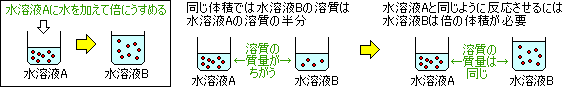
というように、水だけで体積を倍にすると濃度が半分(1/2倍)になります。
濃度が1/2倍になると中の溶質の割合も半分(1/2倍)になります。
同じ体積なら、濃度がχ倍になると中の溶質の質量はχ倍になるということですね。
|
【例題7】マグネシウム1.0gに対してある濃度の塩酸40cm3が過不足なく反応する。
この塩酸を水で3倍にうすめた場合、マグネシウム2.5gと反応できる体積を求めよ。
|
マグネシウム1.0gに対してその塩酸40cm3反応できるので、
マグネシウム:塩酸=1.0g:40cm3 の割合で反応することがわかります。
この塩酸を水で3倍にうすめたなら、濃度は1/3に、中の溶質(塩化水素)の割合も1/3に減っています。
そこで、マグネシウム1.0gと反応できるうすい塩酸の体積は40cm3の3倍(=120cm3)必要になるので、比例式を書き直しましょう。
マグネシウム:塩酸=1.0g:120cm3 これを使って問題を解きます。
2.5gのマグネシウムと反応できる塩酸をycm3として、比例式をつくります。
マグネシウム:塩酸=2.5g:ycm3=1.0g:120cm3 比例式の解き方はこちら
これを書き直して1.0×y=2.5×120 よって、χ=300(cm3)
3倍にうすめたので、例題6の3倍の体積になりました。
発生する気体の体積と質量
気体が発生する化学変化でも、やはり質量保存の法則や定比例の法則は成り立ちます。
気体を質量ではなく体積で提示されている場合も難しく考えず、気体の体積は質量扱いしてかまいません。
同じ温度・同じ気圧なら、気体の質量は体積に比例するからですが、この理由は高校で習います。
|
【例題8】じゅうぶんな量の塩酸に、マグネシウム0.1gを入れると88cm3の水素が発生した。
マグネシウムを0.3g入れた場合は何cm3の水素が発生するか。
|
「じゅうぶんな量」というのは、塩酸が足らなくなることがない、ということです。
純粋にマグネシウムの質量と水素の体積だけで比例式をつくってしまいましょう。
マグネシウム0.1gに対して水素は88cm3発生するので、
マグネシウム:水素=0.1g:88cm3 の割合で反応したことがわかります。
0.3gのマグネシウムで発生する水素をzcm3として、比例式をつくります。
マグネシウム:塩酸=0.3g:zcm3=0.1g:88cm3 比例式の解き方はこちら
これを書き直して0.1×z=0.3×88 よって、χ=264(cm3)
マグネシウムが3倍になったので、発生する水素も3倍になった、というだけのことですが、一応計算しました。
反応する物質の過不足がある化学変化
よくあるグラフ問題の解き方です。反応する物質の過不足があった場合のことも考えます。
過不足なく反応する物質の質量・水溶液の体積・気体の体積の比は一定だということを使っていきます。
|
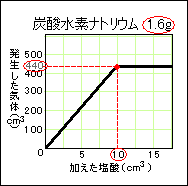
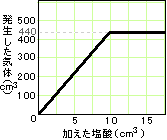
【例題9】炭酸水素ナトリウム1.6gにある濃度の塩酸を加えて
いったとき、加えた塩酸の体積と発生する気体の体積は右
のグラフのようになった。
(1) 2.0gの炭酸水素ナトリウムに同じ濃度の塩酸5cm3を加
えた場合、発生する気体は何cm3か。
(2) この塩酸に水を加え2倍にうすめた場合、炭酸水素ナト
リウム1.0gと過不足なく反応させるには、うすめた塩酸は
何cm3必要か。また、そのとき発生する気体は何cm3か。
|
 |
|
(参考)この反応は 炭酸水素ナトリウム+塩化水素→塩化ナトリウム+水+二酸化炭素 という反応です。
NaHCO3+HCl→NaCl+H2O+CO2
反応の関わる物質(NaHCO3・HCl・NaCl・H2O・CO2)すべての質量の比は決まっています。
グラフの意味を読みとっていきます。
塩酸が10cm3になるまで加えた塩酸の体積と発生した気体の体積は比例しています。
それをこえると気体はもう440cm3以上発生していません。
順番にラジオボタンをクリックしてみてください。
(1)
この濃度の塩酸5cm3では、炭酸水素ナトリウムは0.8gしか反応できません。
よって、使った炭酸水素ナトリウムが2.0gでも、発生する気体はグラフのままです。答え…220cm3
(2)
今までの塩酸の場合、
炭酸ナトリウム:塩酸:気体=1.6g:10cm3:440cm3 で過不足なく反応していました。
この塩酸を2倍にうすめた場合、炭酸ナトリウム1.6gには倍の体積の塩酸が必要なので、これを書き換えましょう。
炭酸ナトリウム:塩酸:気体=1.6g:20cm3:440cm3 この比で考えていきます。
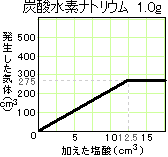
炭酸水素ナトリウム1.0gとちょうど反応する塩酸をχcm3として、
炭酸ナトリウム:塩酸=1.0g:χcm3=1.6g:20cm3
比例式の解き方はこちら
これを書き換え、1.6×χ=1.0×20 よって、χ=12.5(cm3)
このとき発生した気体をycm3とすると、
炭酸ナトリウム:気体=1.0g:ycm3=1.6g:440cm3
比例式の解き方はこちら
これを書き換え、1.6×y=1.0×440 よって、y=275(cm3)
グラフは右のようになると予想できます。
|
 |
top
> 化学変化 > 化学変化と物質の質量 > 気体・水溶液の体積と質量