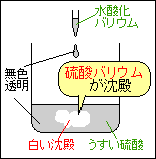
うすい塩酸(酸性)とうすい水酸化ナトリウム水溶液(アルカリ性)を混ぜて液性を調べ、できる塩(えん)を確認します。
BTB溶液を入れておくことによって、液性の変化が見てわかります。
| 順番にラジオボタンをクリックしてみてください。 |

|
|
塩酸と水酸化ナトリウム水溶液を混ぜると、水の中の塩化水素と 塩化水素 + 水酸化ナトリウム → 水 + 塩化ナトリウム 塩酸と水酸化ナトリウムの塩(えん)は塩化ナトリウムです。 |
塩酸も水酸化ナトリウムも危険な薬品ですが、完全に中和させるとただの食塩水になってしまいますね。
この実験で溶媒のほとんどをエタノールにすると、塩化ナトリウムが生成されていくのを見ることができます。
|
濃塩酸と水酸化ナトリウム(固体)の反応(参考)
注:水酸化ナトリウムの粒に濃塩酸を注いではいけません。もっと飛び散って危険です。 |