|
(1)C (2)発生する (3)硫化水素 (4)36.0g (5)硫黄 1.0g |
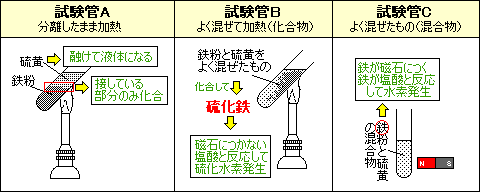
鉄粉と硫黄の化合の実験です。それぞれの試験管の結果から、A〜Cを決めてしまいましょう。
参考ページ…化学変化の種類と実験>化合
・鉄粉と硫黄をよく混ぜて試験管の上部を加熱した後放置したもの
上部を加熱するだけで反応が始まり、放置しても反応が次々に進んで化合物(硫化鉄)ができます。
別の物質になったので鉄の性質も硫黄の性質もありません。
塩酸を加えると硫化水素(卵が腐ったにおい)が発生するので、これはBです。
・鉄粉と硫黄をよく混ぜて放置したもの
ただの鉄と硫黄の混合物です。鉄の性質と硫黄の性質があるので、鉄の性質のため磁石につくのでCです。
・鉄粉、硫黄の順に混ぜずに試験管に入れ、加熱したもの
硫黄がとけて液体になるのでAです。鉄の大部分は変化なしです。加熱の際は鉄と硫黄が接している部分のみ化合します。
これも磁石につきますが、Aがあてはまるので、Cは混ぜただけの試験管だと判断します。
(1)
上の解説より、混ぜただけの試験管はCですね。
(2)
試験管Cは鉄粉と硫黄を混ぜただけの混合物で、鉄の性質により、塩酸と反応して水素が発生します。
(3)
試験管Bは硫化鉄という化合物です。塩酸と反応して硫化水素が発生します。
(4)
化合しても(化学変化が起きても)反応前後の物質全体の質量は変わりません。
試験管の質量が25.0g、鉄粉の質量が7.0g、硫黄の質量が4.0gなので、全部で36.0gです。
参考ページ…化学変化と物質の質量>質量保存の法則
(5)
鉄と硫黄の化合する質量比は7.0(g):4.0(g)=7:4です。
「鉄17.5gと化合できる硫黄の質量」を求めてみます。鉄17.5gと化合する硫黄をχgとすると、
17.5(g):χ(g)=7:4 より、7χ=17.5×4 これを解いて χ=10.0(g)
参考ページ…化学変化と物質の質量>基本問題の解き方 比例式の解き方
硫黄は10.0gが化合できますが、11.0gあるので、0.1g残ります。