乮1乯
丂丂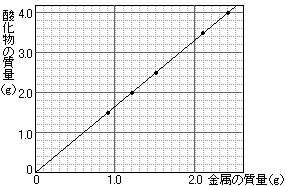
乮2乯3丗2
乮3乯6.0g
乮4乯0.6g
乮5乯嬥懏丗3.3g丂丂巁慺丗2.2g
|
壔崌偡傞暔幙偺幙検偺斾偼堦掕乮掕斾椺偺朄懃乯偲偄偆偒傑傝偐傜夝偄偰偄偒傑偟傚偆丅
嶲峫儁乕僕乧壔妛曄壔偲暔幙偺幙検亜嬥懏偺巁壔偲幙検乮掕斾椺偺朄懃乯
乮1乯
奺斍偺寢壥傪嬥懏偺幙検傪墶幉丄巁壔暔偺幙検傪廲幉偲偟偰僌儔僼偵億僀儞僩偟丄尨揰偲捈慄偱寢傃傑偡丅
偦偺嵺丄D斍偺寢壥偼捈慄偐傜偼傒弌偟傑偡丅D斍偺寢壥傪億僀儞僩偟側偄傛偆偵偟傑偟傚偆丅
昞偺乽巁壔暔偺幙検乮g乯乿傪墶偵尒偰偄偭偰傕傢偐傝傑偡丅
嬥懏偺幙検偑0.3g偢偮傆偊傞偵偟偨偑偭偰1.5丄2.0丄2.5乧乮g乯偲丄巁壔暔偺幙検傕0.5g偢偮傆偊偰偄偭偰偄傑偡偑丄D斍偺偲偙傠偱3.0g偵側傜偢偵2.6g偲側偭偰偄傑偡丅D斍偑幐攕偩偲傢偐傝傑偡丅
乮2乯
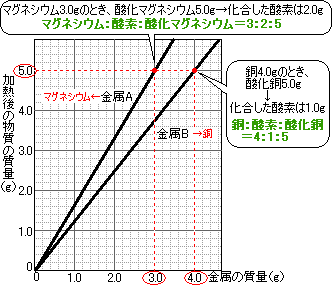
D斍埲奜側傜偳偺斍偺寢壥偱寁嶼偟偰傕偐傑偄傑偣傫偑丄偙偙偱偼A斍偺寢壥傪傕偲偵寁嶼偟偰傒傑偡丅
嬥懏亄巁慺仺巁壔暔
幙検曐懚偺朄懃傛傝丄丂巁壔暔偺幙検亅嬥懏偺幙検亖壔崌偟偨巁慺偺幙検丂偱偡丅
巁壔暔偼1.5g丄嬥懏偼0.9g丄傛偭偰巁慺偺幙検亖1.5乮g乯亅0.9乮g乯亖0.6乮g乯
偙傟傛傝丄嬥懏丗巁慺亖0.9乮g乯丗0.6乮g乯亖3丗2
嬥懏偼儅僌僱僔僂儉偱偡偹丅
乮3乯
愭傎偳偺A斍偺寢壥偐傜丄嬥懏丗巁壔暔亖0.9乮g乯丗1.5乮g乯亖3丗5丂偙偺斾傪巊偭偰寁嶼偟傑偡丅
嬥懏3.6g偐傜摼傜傟傞巁壔暔偺幙検傪冊g偲偟偰丄斾椺幃傪偮偔傝傑偟傚偆丅
嬥懏丗巁壔暔亖3.6乮g乯丗冊乮g乯亖3丗5丂斾椺幃偺夝偒曽
偙傟傪曽掱幃偵捈偡偲丄3冊亖3.6亊5丂偙傟傪夝偄偰丂冊亖6.0乮g乯
仸拞妛偺抜奒偱偼丄摎偊偼6g偱傕偄偄偱偡丅6.0g偼3.6g偵崌傢偣偰夝摎偟傑偟偨丅
嶲峫儁乕僕乧壔妛曄壔偲暔幙偺幙検亜婎杮栤戣偺夝偒曽
乮4乯
幐攕偟偨D斍偱偼丄壛擬偑晄廫暘偩偭偨偨傔丄斀墳偣偢偵巆偭偰偟傑偭偨嬥懏偑偁傞傛偆偱偡丅
偙偆偄偆応崌偼丄壔崌偟偨巁慺偺幙検偵拲栚偟傑偟傚偆丅
壔崌偟偨巁慺偺傇傫偩偗幙検偑傆偊偨偙偲傛傝丄巁慺偺幙検亖2.6乮g乯亅1.8乮g乯亖0.8乮g乯
0.8g偺巁慺偲壔崌偱偒傞嬥懏偺幙検傪倷g偲偟偰丄乮2乯偺寢壥偺乽嬥懏丗巁慺亖3丗2乿傪巊偄傑偡丅
嬥懏丗巁慺亖倷乮g乯丗0.8乮g乯亖3丗2丂偙傟傛傝丄丂2倷亖0.8亊3丂傛偭偰丄倷亖1.2乮g乯
1.8g偺嬥懏偺偆偪丄1.2g偑巁壔偱偒偨傛偆偱偡丅
斀墳偣偢偵巆偭偰偟傑偭偨嬥懏偼丄1.8乮g乯亅1.2乮g乯亖0.6乮g乯
嶲峫儁乕僕乧壔妛曄壔偲暔幙偺幙検亜墳梡栤戣偺夝偒曽
乮5乯
乮2乯傗乮3乯偱媮傔偨斾傪巊偄傑偡丅
嬥懏丗巁慺丗巁壔暔亖3丗2丗5丂椺偊偽5g偺巁壔暔側傜丄3g偺嬥懏偲2g偺巁慺偐傜偱偒偰偄傑偡丅

嬥懏偺幙検傪媮傔傞偲偒偼巁壔暔偺幙検傪5偱妱偭偰3傪偐偗傑偡丅
嬥懏偺幙検亖5.5乮g乯亐5亊3亖3.3乮g乯
巁慺偺幙検傪媮傔傞偲偒偼巁壔暔偺幙検傪5偱妱偭偰2傪偐偗傑偡丅
巁慺偺幙検亖5.5乮g乯亐5亊2亖2.2乮g乯
傕偪傠傫丄斾椺幃偱媮傔偰傕偐傑偄傑偣傫丅
乮1乯儅僌僱僔僂儉
乮2乯巁壔摵
乮3乯嬥懏A丗2Mg亄O2仺2MgO
丂丂嬥懏B丗2Cu亄O2仺2CuO
乮4乯12.0g
乮5乯5.5g
乮6乯8丗3
|
嶲峫儁乕僕乧壔妛曄壔偲暔幙偺幙検亜嬥懏偺巁壔偲幙検乮掕斾椺偺朄懃乯
摵傕儅僌僱僔僂儉傕嬻婥拞偱偠傘偆傇傫壛擬偡傞偙偲偵傛傝丄巁慺偑壔崌偟偰巁壔暔偲側傝傑偡丅
摵亄巁慺仺巁壔摵
儅僌僱僔僂儉亄巁慺仺巁壔儅僌僱僔僂儉
乮1乯
巁壔摵偼崟怓偺暡枛偱偡偑丄巁壔儅僌僱僔僂儉偼敀怓偺暡枛偱偡丅
嬥懏A偺巁壔暔偑敀偐偭偨偲偄偆偙偲偼丄嬥懏A偼儅僌僱僔僂儉偱偡偹丅
乮2乯
嬥懏A偑儅僌僱僔僂儉側偺偱丄嬥懏B偼摵偱偡丅摵偑巁壔偡傞偲巁壔摵偵側傝傑偡丅
乮3乯
嬥懏A乮儅僌僱僔僂儉乯偵偮偄偰
儅僌僱僔僂儉亄巁慺仺巁壔儅僌僱僔僂儉
暔幙柤傪壔妛幃偵抲偒姺偊偰
丵Mg亄丵O2仺丵MgO
斀墳慜屻偺尨巕偺庬椶偲悢傪崌傢偣偰
2Mg亄O2仺2MgO
嬥懏B乮摵乯偵偮偄偰
摵亄巁慺仺巁壔摵
暔幙柤傪壔妛幃偵抲偒姺偊偰
丵Cu亄丵O2仺丵CuO
斀墳慜屻偺尨巕偺庬椶偲悢傪崌傢偣偰
2Cu亄O2仺2CuO
嶲峫儁乕僕乧壔妛斀墳幃亜壔妛斀墳幃偺偮偔傝曽
乮4乯
僌儔僼偺撉傒傗偡偄揰傪偝偑偟偰丄儅僌僱僔僂儉偲
巁壔儅僌僱僔僂儉偺幙検偺斾傪媮傔傑偡丅
嬥懏乮儅僌僱僔僂儉乯偑3.0g偺偲偒偑偍偡偡傔偱偡丅
儅僌僱僔僂儉丗巁壔儅僌僱僔僂儉亖3.0乮g乯丗5.0乮g乯亖3丗5
偙傟傪巊偭偰偙偺栤戣傪夝偒傑偟傚偆丅
|
 |
儅僌僱僔僂儉7.2g偑巁壔偟偰偱偒傞巁壔儅僌僱僔僂儉偺幙検傪冊g偲偡傞偲丄
儅僌僱僔僂儉丗巁壔儅僌僱僔僂儉亖7.2乮g乯丗冊乮g乯亖3丗5丂斾椺幃偺夝偒曽
彂偒姺偊傞偲丄3冊亖7.2亊5丂傛偭偰丄冊亖12.0乮g乯
仸拞妛偺抜奒偱偼丄摎偊偼12g偱傕偄偄偱偡丅12.0g偼7.2g偵崌傢偣偰夝摎偟傑偟偨丅
嶲峫儁乕僕乧壔妛曄壔偲暔幙偺幙検亜婎杮栤戣偺夝偒曽
乮5乯
4.6g偺摵偺偆偪丄斀墳偱偒偢偵巆偭偨摵偑1.0g偩偭偨偲偄偆偙偲偱偡丅
巁壔摵偑墫巁偵偲偗傞偙偲丄摵偑墫巁偵偲偗側偄偙偲傪抦偭偰偄傞昁梫偑偁傝傑偡丅
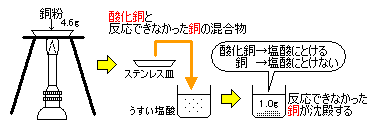
斀墳偟偨摵偼4.6乮g乯亅1.0乮g乯亖3.6乮g乯側偺偱丄3.6g偺摵偵壔崌偱偒傞巁慺偺幙検傪寁嶼偡傟偽偦偺傇傫偑4.6g偐傜傆偊偨幙検偵側傝傑偡丅
乮4乯偺傛偆偵丄僌儔僼偱撉傒偲傝傗偡偄揰傪偝偑偟丄摵偲巁慺偺幙検偺斾傪媮傔傑偟傚偆丅
嬥懏乮摵乯4.0g偺偲偒偵巁壔摵偼5.0乮g乯側偺偱丄壔崌偟偨巁慺偼5.0乮g乯亅4.0乮g乯亖1.0乮g乯
偙傟傛傝丄摵丗巁慺亖4丗1偱偁傞偙偲偑傢偐傝傑偡丅
3.6g偺摵偲壔崌偱偒傞巁慺偺幙検傪倷g偲偡傞偲丄
摵丗巁慺亖3.6乮g乯丗倷乮g乯亖4丗1丂偙傟傪彂偒姺偊偰丂4y亖3.6丂傛偭偰倷亖0.9乮g乯
偙偺幚尡偱偼丄嬻婥拞偐傜0.9g偺巁慺偑壔崌偟偰偒偨偙偲偵側傝傑偡丅
僗僥儞儗僗嶮偺拞偺摵暡偺幙検偼4.6g丄壛擬屻偼偦傟偵巁慺偺幙検傪崌傢偣偰
4.6乮g乯亄0.9乮g乯亖5.5乮g乯
乮6乯
MgO傕CuO傕嬥懏尨巕偲巁慺尨巕偺寢傃偮偔妱崌偼1丗1偱偡丅
壔崌偡傞儅僌僱僔僂儉偲巁慺偺幙検斾偼僌儔僼偐傜3丗2側偺偱丄儅僌僱僔僂儉尨巕偲巁慺尨巕偺幙検斾偼3丗2偲側傝傑偡丅
傑偨丄壔崌偡傞摵偲巁慺偺幙検斾偼僌儔僼偐傜4丗1側偺偱丄摵尨巕偲巁慺尨巕偺幙検斾偼4丗1偲側傝傑偡丅
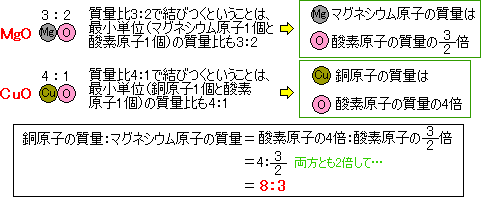
乽摵丗巁慺亖4丗1乿偲乽儅僌僱僔僂儉丗巁慺亖3丗2乿偐傜巁慺偺悢帤傪崌傢偣偰乽摵丗儅僌僱僔僂儉乿傪媮傔偰傕偄偄偱偡丅
摵丗巁慺亖4丗1丂2攞偟偰丂摵丗巁慺亖8丗2乧嘆
儅僌僱僔僂儉丗巁慺亖3丗2乧嘇
嘆丒嘇傛傝丄摨偠幙検偺巁慺偲壔崌偱偒傞摵偲儅僌僱僔僂儉偺幙検斾偼8丗3偲側傝傑偡丅




