前項では化学変化のとき出入りする熱エネルギーを利用できることを紹介しました。
ここでは化学変化で電気エネルギーをとり出す方法をつかんでいきましょう。
熱エネルギーよりも電気エネルギーのほうがほかのエネルギーに変換しやすく、使い道が多いです。
化学電池
|
化学電池…化学変化を利用して電流をとり出す装置
電流を通す水溶液に2種類の金属を入れると電流がとり出せる
-極となる金属の変化…とけていく
+極となる金属の変化…水素が発生する
|
基本的な化学電池のしくみを知っておきましょう。
|
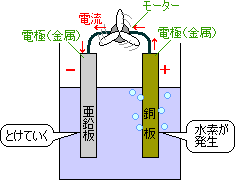
うすい塩酸に亜鉛板と銅板を入れ、
モーターと導線でつなぎます。
電極となった金属板では、
亜鉛板…とけていく
銅板…水素が発生する
の反応が起こり、導線に電流が流れる
亜鉛板が-極、銅板が+極となり、
モーターが回る
↓
電流がとり出せる
|
 |
なぜこの化学変化で電流が発生するのかという理由は、イオンと電流の正体を知らないと理解できません。
現在の中学では習いませんから、「2種類のうちどちらの金属が+極や-極になるのか」「-極の金属はとける・+極の金属からは水素が出る」「どんな水溶液を使ったらいいのか」ということだけ覚えておきましょう。
※どうしても理由を知りたい人は
1.こちらで電流の正体を知る
2.こちらでイオンとは何かを知り、こちらで電解質やイオンになり方を知る
3.こちらで電池のしくみを知る
で勉強してくださいね。
2種類の金属のどちらがどの極になるか
電池に入れる電極用の金属は必ずちがう種類でなくてはいけません。(同じ種類の金属だと電流は流れません)
発生する電流や電圧の大きさは金属の組み合わせでちがいます。
|
とけやすいほうの金属→-極となり、とけていく
とけにくいほうの金属 →+極となり、水素を発生する
とけやすさ Al(アルミニウム)>Zn(亜鉛)>Fe(鉄)>Cu(銅)
(この中では銅がいちばんとけにくい)
|
この4種類の金属の順番だけ覚えておくとラクです。
【例】どちらか片方が銅なら、銅が+極となる
鉄と亜鉛なら、亜鉛が-極、鉄が+極となる
どんな水溶液を使うか
電極を入れる水溶液は何でもいいわけではありません。電流を通す水溶液を使います。
酸性・アルカリ性の水溶液(必ず電流を通す)
塩酸・硫酸・酢・果汁・水酸化ナトリウム水溶液・スポーツドリンクなど
中性の水溶液(電流を通すものがある)
食塩水・硫酸銅水溶液など
砂糖水・純粋な水・エタノールなど、電流を通さない液は使えません。

top
> 化学エネルギー > 化学変化とエネルギー > 化学電池
