イオンはおもに水溶液の中で存在しています。単体では不安定で存在できないような原子(Na、Clなど)もイオンの形で安定を保っています。
電流を通す水溶液と通さない水溶液がありますね。水中のイオンについて考えてみましょう。
電解質と非電解質
すべての化合物が水にとけるわけではありませんが、水にとける物質の水溶液で、電流を通すものがありますね。
電流を通さない水溶液もあります。
水にとかしたとき、水溶液が電流を通す物質を電解質、水溶液が電流を通さない物質を非電解質といいます。
| 電解質
水溶液に電流が流れる物質
(水にとけるとイオンになる物質)
|
非電解質
水溶液に電流が流れない物質
(水にとけてもイオンにならない物質)
|
塩化ナトリウム
水溶液は塩化ナトリウム水溶液(食塩水)
塩化水素
水溶液は塩酸
塩化銅
水溶液は塩化銅水溶液
水酸化ナトリウム
水溶液は水酸化ナトリウム水溶液
など
|
砂糖
水溶液は砂糖水
エタノール
水溶液はエタノール水溶液
など
|
※ここで注意するのは、電解質・非電解質は溶質のことです。水溶液は電解質・非電解質とは呼びません。
また、水にとけない物質は電解質でも非電解質でもありません。
水溶液が酸性やアルカリ性を示す場合は、溶質は電解質であると思っていいです。
ただし、中性の水溶液の溶質であっても、電解質である場合もあります(塩化ナトリウムなど)。
電離
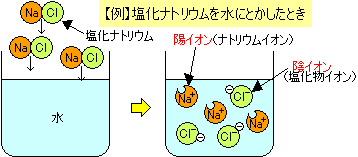
塩化ナトリウム(食塩)は固体の状態のときには電流を通しませんが、水にとかすと水溶液に電流が流れますね。
金属(導体)を流れる電流の正体は−の電気をおびた自由電子でした。電流の正体はこちらで復習してください。
水溶液の中では電気をおびたイオンが電流を流す役目をはたします。
|
電離…電解質が水にとけて陽イオンと陰イオンに分かれること
|
|
電解質→陽イオン+陰イオン
【例】
NaCl→Na++Cl-
HCl→H++Cl-
NaOH→Na++OH-
CuCl2→Cu2++2Cl-(参考)
FeCl2→Fe2++2Cl-(参考)
|
|
電離を表す式
電解質が電離するときのようすはイオンの記号を使って表します。
電離の前はその化学式、電離のあとはイオンの記号で表しましょう。
|
塩化ナトリウム→ナトリウムイオン+塩化物イオン NaCl→Na++Cl-
|
|
塩化水素→水素イオン+塩化物イオン HCl→H++Cl-
|
|
水酸化ナトリウム→ナトリウムイオン+水酸化物イオン NaOH→Na++OH-
|
|
(参考)塩化銅→銅イオン+塩化物イオン CuCl2→Cu2++2Cl-
|
|
(参考)塩化鉄→鉄イオン+塩化物イオン FeCl2→Fe2++2Cl-
|
イオン結合(参考)
電解質は水にとけると陽イオンと陰イオンに分かれます。
水の中ではイオンは自由に動けるので、電解質は水にとけて電離するのですね。
電解質はもともと、陽イオンと陰イオンが電気の力で結び付いてできていたものです。
このようなイオンどうしの結びつきをイオン結合といいます。
水溶液中のイオンも、水がすべて蒸発するとまた引き合ってイオン結合します。

イオン結合している化合物の例
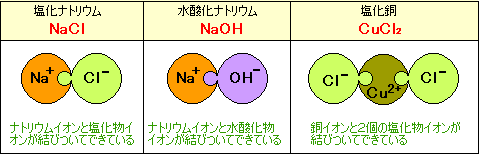
※OH-のO(酸素原子)とH(水素原子)の結びつきはイオン結合でなく、もっと強いほかの種類の結びつきです。
top
> イオン > 電気分解 > 電解質と非電解質


