電池は化学変化を利用して電流をとり出す装置です。
種類もふつうの乾電池(マンガンやアルカリ)、充電できるニッケル水素電池、太陽電池、車のバッテリー(鉛蓄電池)など、いろいろありますが、最初に電池を発明したボルタの電池でカンタンなしくみを理解していきましょう。
|
電池(化学電池)に必要なものは次の2点です。
うすい硫酸に亜鉛板と銅板を入れて | 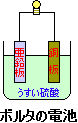 |
電池
いつもお世話になっている乾電池。こんなものでなぜ電気を作り出せるのか不思議ですね。
電池は電解質の水溶液と種類のちがう金属があればつくることができます。実はここでもイオンが大いに役に立っているのです。
ボルタの電池
電池は化学変化を利用して電流をとり出す装置です。
種類もふつうの乾電池(マンガンやアルカリ)、充電できるニッケル水素電池、太陽電池、車のバッテリー(鉛蓄電池)など、いろいろありますが、最初に電池を発明したボルタの電池でカンタンなしくみを理解していきましょう。
電池(化学電池)に必要なものは次の2点です。
①電解質の水溶液
ボルタの電池ではうすい硫酸を使っています。②2種類の金属
電極となります。
ボルタの電池では亜鉛板と銅板を使っています。うすい硫酸に亜鉛板と銅板を入れて
導線でつないだものがボルタの電池です。
電池の原理
では、どのような原理で電流をとり出すのかをつかみましょう。
順番にラジオボタンをクリックしてみてください。
こうして電子が亜鉛板から銅板へ流れる回路ができあがります。
結果的には亜鉛板が-極、銅板が+極となる電池ができたのですね。電子の流れの向きと電流の向きについてはこちらで復習しましょう。金属にはイオンになりやすい・なりにくいの順番があって、
先にイオン化する金属が-極となります。2種類の金属のイオンになりやすさのちがいによって
電流をとり出すことができます。
だから、同じ種類の金属を使うと電池はできません。
イオンになりやすさ
くわしくは次の「イオン化傾向」で紹介しますが、中学ではこれらの金属の順番だけ知っておけばよいです。
マグネシウム・アルミニウム・亜鉛のどれかを-極として、銅を+極として利用する場合が多いです。
もしも、マグネシウムと亜鉛の2種類を使った場合、マグネシウムのほうがイオンになりやすいので-極となり、亜鉛が+極となるわけです。
top > イオン > 電池 > 電池のしくみ