電気分解
化学変化の単元で習った水の電気分解を覚えていますか?電流を流すと分解できてしまうのは「イオン」のはたらきです。
「イオン」ということばは有名ですが、その正体を正しく理解されていることが少ないようです。ここでしっかりおさえておきましょう。
イオンとは
実は単体として存在するより、イオンになって存在しているほうが安定である原子も多くあります。
実際にわたしたちのからだの中や海水などあらゆる液内にさまざまなイオンが存在しています。
|
イオン…原子が電気をおびたもの
+の電気をおびた原子…陽イオン
−の電気をおびた原子…陰イオン
水の中を自由に動くことができる(イオンは水中に存在できる)
|
陽イオンと陰イオン
原子は+でも−でもなく、原子全体としては電気的に中性です。
原子のしくみは中学では習いませんが、こちらを参考にしてください。
原子がよぶんに電子を受けとったり、電子を失ったりして全体的に電気をおびた状態のものがイオンです。
それぞれの原子は種類によって、「電子を受けとりやすい」か「電子を失いやすい」という性質をもっています。
ここでしっかり思い出してほしいのは、 電子は−の電気をおびた粒子 だということです。
|
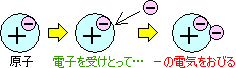
電子を受けとりやすい原子の場合
電子をよぶんにもつので−の電気をおびる
↓
陰イオンになる
|  |
|
電子を失いやすい原子の場合
電子がへるので+の電気をおびる
↓
陽イオンになる
|  |
イオンの記号
イオンは+と−の2種類ありますね。
どんな原子がどんな電気をおびたか、原子の記号の右上に小さく+か−をつけて表します。
原子の記号を忘れてしまった人はこちらで復習してください。
覚えておきたいイオンをまとめておきます。
| +/− |
イオンの記号
|
イオンの名前
|
その他
|
陰イオン
(−)
|
Cl-
|
塩化物イオン
|
Cl(塩素原子)が電子を1個受けとって
陰イオンになる。
|
|
OH-
|
水酸化物イオン
|
OH(酸素原子と水素原子が結びついた
もの)が電子を1個受けとって
陰イオンとなる。 アルカリ性を示す。
|
陽イオン
(+)
|
H+
|
水素イオン
|
H(水素原子)が電子を1個失って
陽イオンになる。 酸性を示す。
|
|
Na+
|
ナトリウムイオン
|
Na(ナトリウム原子)が電子を1個失って
陽イオンになる。
|
|
(参考)Cu2+
|
銅イオン
|
Cu(銅原子)が電子を2個失って
陽イオンになる。
|
|
(参考)Fe2+
|
鉄イオン
|
Fe(鉄原子)が電子を2個失って
陽イオンになる。(3個失うときもあります)
|
※陰イオンの多くは「〜化物イオン」や「〜酸イオン」という名前です。
塩化物イオンを塩素イオンと呼ばないように気をつけましょう。ここでは、得たり失ったりする電子の数が1個のものだけ扱います。
イオンの色(参考)
水中のイオンには色がついているものもあります。種類ごとのイオンの色を紹介しておきます。
銅イオンの色だけ覚えておくといいですね。
※イオンは「水にとけている」ので、すべて透明です。銅イオンの青色は有名ですね。
硫酸銅の結晶も青いですが、結晶自体に「結晶水」という水がふくまれているので青くなっています。
その結晶を熱して水が除かれると青ではなくなります(白色になります)。
原子によっては、イオンでいるほうがはるかに安定した種類もあります。
Na(ナトリウム)は金属のひとつですが、単体では不安定でイオンになりたがるので、自然界にナトリウム金属の単体は存在できません。
非常に安定した原子(He、Ne、Arなどの希ガス)と電子の数が同じになるように電子を受けとったり失ったりしてイオンになろうとする原子が多いです。
周期表を参考にしてください。
top
> イオン > 電気分解 > イオンとは


