|
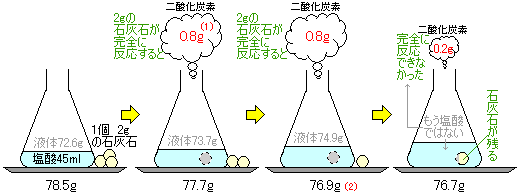
塩酸45mlを入れた三角フラスコと、質量が2.0gの石灰石のかけらが3個ある。 この三角フラスコと3個の石灰石をあわせた質量は、78.5gであった。 次にこの三角フラスコに石灰石のかけらをひとつ入れ、塩酸とじゅうぶんに反応させてから、 三角フラスコと残りの石灰石をあわせた質量を測定したところ、質量は77.7gとなった。 (1) 石灰石のかけらをひとつ入れたときに発生した気体の質量は何gか。 (2) 石灰石のかけらをもうひとつ入れ、塩酸とじゅうぶんに反応させた。 三角フラスコと残りの石灰石をあわせた質量は何gか。 (3) 3個の石灰石を全部入れて塩酸と反応させたところ、三角フラスコの中に石灰石が少し残った。 このときの三角フラスコの質量を測定したところ76.7gであった。 三角フラスコの中に残った石灰石の質量は何gか。 (4) この塩酸45mlとちょうど反応する石灰石の量は何gか。 (5) 残った石灰石をじゅうぶんに反応させるためには、同じ濃度の塩酸をあと何ml加えればよいか。 ご質問: かいさん(2003/12/18) |
まず、数量関係を確認
塩酸に石灰石を加えるのは二酸化炭素の発生方法として有名です。
塩酸と石灰石を反応させると二酸化炭素が発生して塩酸から外に逃げていきます。
問題文の数量関係を整理してみます。今わかっているのは1個2gの石灰石、78.5g、77.7g、76.7gだけです。

塩酸と石灰水が完全に反応すると
塩酸+石灰石→塩化カルシウム+水+二酸化炭素
という反応になります。参考ページ…気体>気体に関する化学変化(参考)
反応後、石灰石はすべてなくなって二酸化炭素に変わるのではなく、塩酸中にほかの形となって残る質量があります。
(1)
石灰石1個(2g)を完全に反応させたあと、質量が減っています。
発生した二酸化炭素が液体から外に逃げたからですね。
参考ページ…化学変化と物質の質量>質量保存の法則
にげた気体の質量は、
78.5(g)−77.7(g)=0.8(g)
0.8gの二酸化炭素が発生したのがわかります。
(2)
(1)より、2gの石灰石が完全に反応すると0.8gの二酸化炭素が発生することがわかりました。
もう1個石灰石を完全に反応させると、また0.8gの二酸化炭素が逃げていくはずなので、全体の質量は
77.7(g)−0.8(g)=76.9(g)
(3)
(2)の76.9gからどれだけの二酸化炭素が生じて逃げたか計算しましょう。
76.9(g)−76.7(g)=0.2(g)
本来なら0.8g減ってほしいところですが、0.2gしか減っていません。
2gの石灰石がすべて完全に反応すれば0.8g減りますが、反応できなかった石灰石があるということですね。
0.8gのうち0.2g発生したということは、4分の1の石灰石が反応したということです。(0.2は0.8の4分の1)
石灰石は2gだったので、その4分の1が反応して4分の3は余ってしまいます。
反応したのは
2(g)÷4=0.5(g) 反応できなかったのは2(g)−0.5(g)=1.5(g)より、1.5gになります。
※これを「2g入れて0.2g減ったから、残った石灰石は1.8gだ」とするとまずいです。
このうち0.3gは塩化カルシウム水溶液として液中にとけこんでいるので、石灰石として残るのは、1.5gです。
(4)
それまでに入れた2個の石灰石(合計4g)はすべて反応できましたね。
(3)でも、石灰石0.5gは反応できました。
ということは、4(g)+0.5(g)=4.5(g)
この濃度の塩酸45mlに対して、4.5gの石灰石がちょうど反応できるわけです。
(5)
残った石灰石は1.5gです。
(4)の解答より、塩酸45mlに対して石灰石4.5gなので、この割合を利用して1.5gの石灰石に対して塩酸は何ml必要か計算しましょう。
χmlとして比例式を使えば確実です。参考ページ…比例式の解き方
45(ml):4.5(g)=χ(ml):1.5(g)
よって、4.5χ=45×1.5 これを解いてχ=15(ml)
この濃度の塩酸はあと15ml必要です。
※この問題の場合に限っては、いちいち比を使わなくても、「45mlで4.5g」なんて数値が1ケタ違うだけでよく似ているので、「1.5gなら15ml」とすぐ感覚で求まります。
答え
|
(1) 0.8g |