|
還元…酸素がとり去られる化学変化 |
酸化物に炭素を加えて加熱すると酸化物の酸素が炭素にうばわれて、炭素が代わりに酸化します。
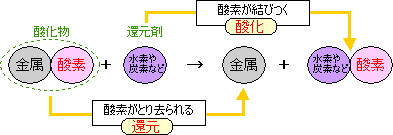
酸化・還元が同時に起きるので、 「酸化還元反応」と呼ばれます。
酸化してしまった金属は使い物にならない場合が多いです。
しかし、物質による酸素との結びつきやすさの違いを利用して、酸化物から酸素をとりのぞくことができます。
酸素をとり去ったあとの金属は、もう一度材料として使えますね。
酸化還元反応
還元…酸素がとり去られる化学変化
酸化物に炭素を加えて加熱すると酸化物の酸素が炭素にうばわれて、炭素が代わりに酸化します。

酸化・還元が同時に起きるので、 「酸化還元反応」と呼ばれます。
炭素を使って酸化銅から銅をとり出す
具体的な酸化還元反応を見ていきましょう。
酸化銅に炭素の粉末を混ぜて加熱します。
実験の結果 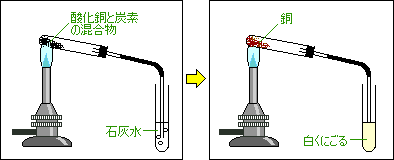
反応前
酸化銅(黒色)
炭素(黒色)反応後
銅(赤かっ色)
二酸化炭素(気体)確かめ方 二酸化炭素
石灰水が白くにごる銅
たたくとのびる こすると光る 電気を通す →金属の性質を持つ実験の注意 石灰水が逆流しないように、火を消す前にガラス管を石灰水からぬく。
(加熱された試験管が急に冷えて割れるのを防ぐためです)酸化銅 + 炭素 → 銅 + 二酸化炭素
2CuO + C → 2Cu + CO2
※酸素は銅よりも炭素と仲がいいので、炭素が酸化銅から酸素をうばって、炭素自身が酸化し、二酸化炭素となります。
酸化銅は還元されて銅となります。炭素はこの場合、「還元剤」と呼ばれることもあります。
水素(酸素と大変仲良し)もよい還元剤として使われます。
製鉄所では酸化鉄をコークス(炭素)で還元して鉄を精製しています。
水素を使って酸化銅から銅をとり出す
水素による還元も紹介しておきます。
実験の結果 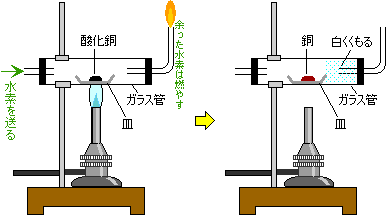
反応前
酸化銅(黒色)
水素(気体)反応後
銅(赤かっ色)
水(水蒸気で発生、冷えて水滴になる)確かめ方 水
ガラス管の口付近が白くくもる→水が発生銅
たたくとのびる こすると光る 電気を通す →金属の性質を持つ酸化銅 + 水素 → 銅 + 水
CuO + H2 → Cu + H2O
分解と還元(参考)
2年生で酸化銀の分解を習いましたね。忘れてしまった人はこちら。
酸化銀を加熱すると、銀と酸素に分解してしまいました。(酸化銀→銀+酸素)
「酸化銀から酸素がとれて銀ができたので還元」なのか、「1種類の物質が2種類の物質に分かれたので分解」なのか迷うところですね。中学の段階では、「酸化銀の分解」は還元とはいわないほうが無難です。
中学では還元の例として還元剤(代わりに酸化される物質)がある場合を習います。
これは実は狭い意味での「還元」です。高校以上になって酸化・還元の広い意味を習えば、「酸化銀の分解」は還元反応であるといえますが、今は「分解」だけで覚えておいてくださいね。
もともと中学では、化学変化の種類はまず狭い意味で習います。
「化合」や「分解」も本来の意味で習っていますが、実際に使う表現としては「有機物を酸化する」と言ったり、「酸素を使って養分を分解する」とも言ったりします。
このように、実際の化学変化は2種類以上の物質が別の2種類以上の物質になる変化が多いです。
(化合と分解が同時に起こっているという状況をイメージしてください。)高校になったときに混乱しないようにしてくださいね。
今は基礎を固めるために、まず狭い意味で身につけておきましょう。
※広い意味の酸化・還元はこちらで紹介しています。覚えなくていいですが、参考にしてください。
top > 化学エネルギー > 酸化と還元 > 還元