分解…1種類の物質が2種類以上の物質に分かれる化学変化
炭酸水素ナトリウムの分解
| 実験の結果 |
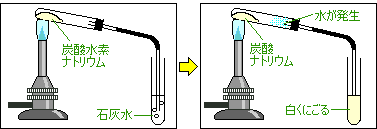 |
反応前
炭酸水素ナトリウム(白い固体)
反応後
炭酸ナトリウム(白い固体) 水(液体) 二酸化炭素(気体) |
| 確かめ方 |
指示薬はこちらで確認(×で閉じてください)
|
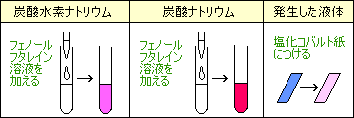
炭酸水素ナトリウム
・水にとけにくい
・水溶液にフェノールフタレイン溶液を加えるとうすい赤色(弱アルカリ性)炭酸ナトリウム
・水によくとける
・水溶液にフェノールフタレイン溶液を加えると濃い赤色(アルカリ性)
水
塩化コバルト紙につけると青→赤
二酸化炭素
石灰水が白くにごる
|
| 実験の注意 |
・できた液体が加熱された試験管の底に流れないように
試験管の口を下げる。
・石灰水が逆流しないように、
火を消す前にガラス管を石灰水からぬいておく。
(どちらも、加熱された試験管が急に冷えて割れるのを防ぐためです) |
| 炭酸水素ナトリウム → 炭酸ナトリウム + 水 + 二酸化炭素 |
※炭酸水素ナトリウムは「重曹」などと呼ばれ、食品店や薬局で売っています。
ケーキにつかうベーキングパウダー(ふくらし粉)の主成分で、熱して発生する二酸化炭素でケーキをふくらませます。
酸化銀の分解
| 実験の結果 |
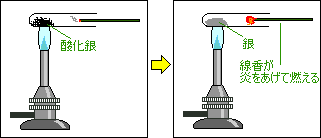 |
反応前
酸化銀
(黒色)
反応後
銀
(白っぽい固体)
酸素(気体) |
| 確かめ方 |
酸素
火のついた線香を入れると炎をあげて燃える銀
たたくとのびる こすると光る 電気を通す →金属の性質を持つ
|
| 実験の注意 |
水上置換で酸素を集める場合、水が逆流しないように、
火を消す前にガラス管を水からぬいておく。
(加熱された試験管が急に冷えて割れるのを防ぐためです) |
| 酸化銀 → 銀 + 酸素 |
※もともと酸素と銀は大変仲が悪く、熱するだけでカンタンに分解してしまいます。
酸化銀をつくるときも、空気中で銀を熱するだけでは無理で、特別な方法でつくります。
水の電気分解
| 実験の結果 |
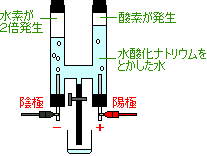 |
反応前
水(液体)反応後
水素(気体)
陰極(−)に発生
酸素(気体)
陽極(+)に発生 体積比
水素:酸素=2:1 |
| 確かめ方 |
|
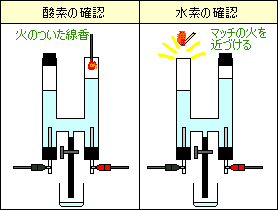
酸素
火のついた線香を入れると炎をあげて燃える
水素
マッチの火を近づけると、ポンと音をたてて燃える
(爆発して水ができる)
|
| 実験の注意 |
・純粋な水は電流を通さないので、電流を流すため、
水酸化ナトリウムを少量とかす。
・電流を流すときはゴムせんのピンチコックを開けておく。
電流を流さないときは閉じておく。
・水酸化ナトリウム水溶液が目に入ったり、手や衣服につかないように
注意する。 |
| 水 → 水素 + 酸素 |
※酸素と水素は非常に仲がよいので、熱しただけでは状態変化を起こすだけで分解しません。
なぜ、陽極に酸素が、陰極に水素が発生するのかは、高校化学の「イオン」の単元で習います。今は丸暗記してください。
どうしても気になる人は、こちらでイオンを紹介しております。参考にしてください。
塩酸の電気分解
| 実験の結果 |
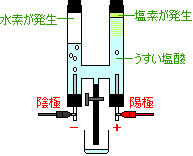 |
反応前
塩酸(塩化水素の水溶液)反応後
水素(気体)
陰極(−)に発生
塩素(気体)
陽極(+)に発生
体積のちがい
水素に対して塩素はあまり集まらない
実は水素と塩素は同じ体積発生しますが、発生した塩素が水にとけてしまうためです。 |
| 確かめ方 |
|
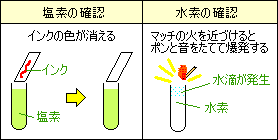
塩素
塩素が発生した付近の水に赤インクをたらすと色が消える
(ろ紙につけたインクが塩素に近づけると消える)
水素
マッチの火を近づけると、ポンと音をたてて燃える
(爆発して水ができる)
|
| 実験の注意 |
・電流を流すときはゴムせんのピンチコックを開けておく。
電流を流さないときは閉じておく。
・塩素は有毒なので、換気をよくして吸わないようにする。 |
| 塩化水素 → 水素 + 塩素 |
※なぜ、陽極に塩素が、陰極に水素が発生するのかは、高校で習います。今は丸暗記してください。
どうしても気になる人は、こちらでイオンを紹介しております。参考にしてください。
塩化銅の電気分解
| 実験の結果 |
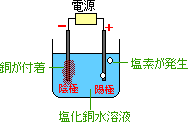 |
反応前
塩化銅水溶液
反応後
銅(赤っぽい固体)
陰極(−)に付着
塩素(気体)
陽極(+)に発生
|
| 確かめ方 |
塩素
陽極付近の水に赤インクをたらすと色が消える
銅
たたくとのびる こすると光る 電気を通す →金属の性質を持つ
|
| 実験の注意 |
塩素は有毒なので、換気をよくして吸わないようにする。 |
| 塩化銅 → 銅 + 塩素 |
※なぜ、陽極に塩素が、陰極に銅が発生するのかは、高校で習います。今は丸暗記してください。
どうしても気になる人は、こちらでイオンを紹介しております。参考にしてください。
top
> 化学変化 > 化学変化の種類と実験 > 分解







