|
水にとけて酸性を示す化合物を酸といいます。 酸 → 水素イオン + 陰イオン のように電離します。 | 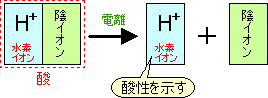 |
たとえば塩酸なら HCl → H+ + Cl- というように、陰イオンはその酸によって決まりますが、共通して水素イオン(H+)が水溶液中に存在しています。
この水素イオン(H+)が酸性の性質を示すものです。
※水素イオンがリトマス紙を赤くしていたのですね。
水素イオンよりイオンになりやすい金属を酸性の水溶液に入れると水素が発生します。
中和
小学校のときから、酸性・アルカリ性という性質をリトマス紙で調べたりしてきていますね。
「酸性」「アルカリ性」「中性」という性質自体は身近なものですが、その正体をここで勉強していきましょう。
酸性の水溶液
酸性の水溶液にはどんなものがあるか、また、その性質を少し思い出してみましょう。
強い酸性 弱い酸性 塩酸(HCl水溶液)
硫酸(H2SO4水溶液)
硝酸(HNO3水溶液)
など炭酸(H2CO3) 二酸化炭素が水にとけたもの
酢酸 酢の主成分
クエン酸 ミカンなどにふくまれています
など※HCl以外の化学式は、中学では覚える必要はありません。共通して「H」をふくんでいることに注目しましょう。
酸性の水溶液の性質
・酸味をもつ(すっぱい)
・青色リトマス紙を赤色に変える
・BTB溶液を黄色にする
・亜鉛などの金属と反応して水素を発生する
・電流を通す※リトマス紙やBTB溶液については、忘れた場合こちらで確認してください。
酸の電離
水にとけて酸性を示す化合物を酸といいます。
酸は水にとけると、酸 → 水素イオン + 陰イオン
のように電離します。
たとえば塩酸なら HCl → H+ + Cl- というように、陰イオンはその酸によって決まりますが、共通して水素イオン(H+)が水溶液中に存在しています。
この水素イオン(H+)が酸性の性質を示すものです。※水素イオンがリトマス紙を赤くしていたのですね。
水素イオンよりイオンになりやすい金属を酸性の水溶液に入れると水素が発生します。
|
酸とアルカリではよく見る問題ですね。
塩酸は水溶液中でHCl → H+ + Cl-
と電離します。塩酸は酸性なので、水溶液中の水素イオン(H+)が青色リトマス紙を赤く変えるはずです。
電圧をかける
‖
片端が陽極(+)に、もう片端が陰極(−)になるということなので、水素イオン(H+)は陰極(−)に、
塩化物イオン(Cl-)は陽極(+)に引かれ、移動します。色が変わるのは陰極側の青色リトマス紙ですね。
電離の割合(参考)
酸性の水溶液中で溶質(酸)がすべて電離しているわけではありません。
電離の割合で酸の強弱が決められています。・電離の割合が高いもの(一定の体積で水素イオンの数が多いもの)…強い酸
・電離の割合が低いもの(一定の体積で水素イオンの数が少ないもの)…弱い酸水の電気分解のところで説明したように、水も弱く電離して水素イオンが存在しています。
水の平均の水素イオンの濃度のときを基準(中性)にして、水素イオン濃度でpH(0〜14)が決まります。
(pHが7のとき中性)
top > イオン > 中和 > 酸