どんな実験だったか思い出してみましょう。純粋な水は電流を通さないので、少量の水酸化ナトリウムをとかしました。
|
電流を流すと、 陰極…水素が酸素の2倍の体積発生 陽極…酸素が発生
| 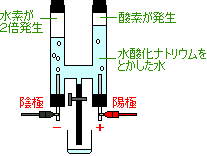 |
実は水酸化ナトリウム水溶液に電流を流していたわけです。水酸化ナトリウムは水溶液中で
NaOH→Na++OH-
のように電離しているはずですね。
今までのように考えると、陰極には金属のナトリウム(Na)が付着してしまような気がしますが、ちゃんと水が分解されて水素と酸素が発生します。
化学変化の単元で「水の電気分解」を習いましたね。
実は水の電気分解は今までの電気分解とちがって、ちょっと特殊でむずかしいです。参考までに説明しておきます。
水の電気分解の実験
どんな実験だったか思い出してみましょう。純粋な水は電流を通さないので、少量の水酸化ナトリウムをとかしました。
電流を流すと、
陰極…水素が酸素の2倍の体積発生
陽極…酸素が発生
実は水酸化ナトリウム水溶液に電流を流していたわけです。水酸化ナトリウムは水溶液中で
NaOH→Na++OH-
のように電離しているはずですね。
今までのように考えると、陰極には金属のナトリウム(Na)が付着してしまような気がしますが、ちゃんと水が分解されて水素と酸素が発生します。
水の電気分解のしくみ
水酸化ナトリウムを水にとかすと、ナトリウムイオン(Na+)と水酸化物イオン(OH-)に電離します。
水自体もほんの少し電離して、 H2O → H+ + OH- というように水素イオンと水酸化物イオンに分かれています。
水溶液に電圧をかけると…
陰極のようす
陰極に水素イオンとナトリウムイオンが
引かれてきます。ナトリウムイオンは原子になるより、
はるかにイオンでいたほうが安定しているので、ナトリウムイオン自体は水溶液中に残ってしまいます。そのかわり、水素イオンが電子を受けとり、陰極からは水素が発生します。
陽極のようす
陽極に水酸化物イオンが引かれてきます。
水酸化物イオンは陽極に電子をわたし、
水と酸素になります。その酸素が陽極から発生します。
水素イオンは陽イオンなので、必ず陰極から発生することを知っていれば大丈夫ですね。
(参考)
金属のナトリウムを電気分解で取り出すときは水を使わず、塩化ナトリウムや水酸化ナトリウムを高温にして融解した状態で電気分解します。
硫酸イオン
水の電気分解のときに硫酸(H2SO4)を使っても同じ結果です。
硫酸イオン(SO42-)のほうが水の中のOH-よりイオンでいる傾向が強いので、硫酸イオンはそのまま水溶液中に残り、OH-が電子を陽極にわたして水と酸素が発生します。同様の理由で、硫酸銅(CuSO4)水溶液を電気分解したときも陰極には銅が付着し、陽極からは酸素が発生します。
top > イオン > 電気分解 > 水の電気分解(参考)