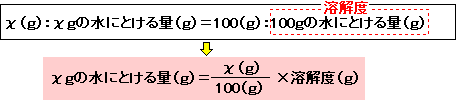溶媒の水が高温であるほど溶質がたくさんとけることは、小学校で習いましたね。
また、物質によっては水にたくさんとけるもの、あまりとけないものと、いろいろあります。
ここでは、温度によって溶質のとける限度の量がどのようになっているか、また、それを利用して溶質をとり出す方法についてつかんでください。
溶解度
物質によって一定の量の水にとける限度がちがいます。
|
溶解度…一定の量の水にとかすことができるその物質の限度の質量
飽和水溶液…物質が溶解度までとけている水溶液(これ以上溶質はとかせません)
|
また、同じ物質でも、水の温度によってとける限度が変わってきます。
|
その物質の溶解度と水の温度との関係を
グラフや表で表すことが多いです。
いっぱんに
水の温度が高いほどたくさんとけます。
(水の温度が低いほどよくとける物質もあります)
右は教科書などでよく見るミョウバン・硝酸カリウム・ホウ酸・食塩の溶解度のグラフです。
ミョウバンは60℃をこえたあたりから一気に
たくさんとけるようになりますね。
食塩は水の温度があがってもほとんど溶解度が
上がりません。
|
 |
グラフにはありませんが、砂糖はかなり溶解度が大きいです。
100gの水はコップに半分ほどの量ですが、低温の水でも、水の量よりたくさんとけます。
100℃なら砂糖は1kg入りの袋の半分近くもとけてしまいます。
再結晶
「物質によって一定の量の水にとける限度が決まっている」「水の温度が高いほどよくとける」ということを利用して、水溶液にとけている固体の溶質をとり出すことができます。
|
再結晶…一度とかした物質を再び結晶としてとり出すこと
・冷やす…固体の物質が多くとけていれば、冷やすと
とけきれなくなった物質が固体として出てくる
・加熱する…固体の物質がとけていた水溶液の水が蒸発し、
とけていた物質が固体として出てくる
|
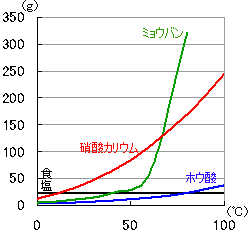
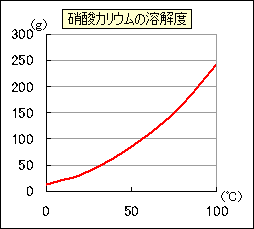
どれだけ冷やせばどのくらいの量が再結晶するか、グラフや表から読みとります。
例として、80℃の水100gに硝酸カリウムを100gとかし、20℃まで温度を下げたときを考えてみましょう。
冷やしていくので、グラフは右から左へ見ていきます。
|
順番にラジオボタンをクリックしてみてください。
|
|
100gの水にとかすなら溶解度のグラフをそのまま読みとればいいですね。
もし、50gの水なら溶解度も半分にして計算しましょう。
χgの水に対するとける限度の質量を計算
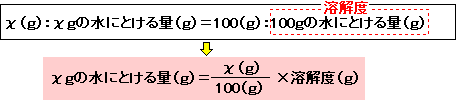
で求めることができます。
※比例式を使いました。
|
【例】ある温度のときのミョウバンの溶解度が23.5gのとき、
この温度の水20gには何gとけるか。
|
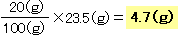
20gの水には4.7gとけることがわかりました。
※一応計算しましたが、100gの水に対して20gが5分の1だと感覚でわかれば、単に23.5gを5分の1にしてしまってかまいません。
大きな結晶をつくるには
もともと、「結晶」というものはただの固体のことではありません。
結晶…規則正しい面で囲まれた固体(原子・分子が規則正しくならんでいるため)
純粋な物質では、結晶の色や形は物質によって決まっています。
再結晶のときに時間をかけて結晶化させると大きな美しい結晶になります。
飽和水溶液の中に小さな結晶を糸でたらし、ゆっくり温度を下げる
※急に冷やしたり、あわてて水分を蒸発させたりしすると、小さな結晶か、くずれたものになります。
 ※解答は半角数字で入力してくださいね。
※解答は半角数字で入力してくださいね。
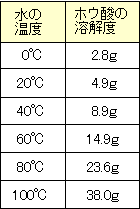
右の表は100gの水にとけるホウ酸の質量を示している。
|
①60℃の水100gには何gのホウ酸がとけることができるか?
②60℃の水100gにホウ酸12.6gをとかした液を20℃まで
冷やしたら何gのホウ酸が結晶として出てくるか?
③80℃の水50gでホウ酸の飽和水溶液をつくりたい。
何gのホウ酸が必要か?
|
 |
top
> 身のまわりの物質 > 水溶液 > 溶解度