|
水にとけてアルカリ性を示す化合物を アルカリ→陽イオン+水酸化物イオン のように電離します。 | 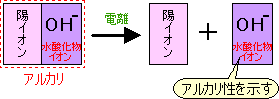 |
たとえば水酸化ナトリウムなら NaOH → Na+ + OH- というように、陽イオンはそのアルカリによって決まりますが、共通して水酸化物イオン(OH-)が水溶液中に存在しています。
この水酸化物イオン(OH-)がアルカリの性質を示すものです。
※水酸化物イオンがリトマス紙を青くしていたのですね。
酸性のものはすっぱく、アルカリ性のものは苦い、というのは有名なのではないでしょうか。
アルカリということばも聞き慣れたことばです。
酸性の正体が水素イオンであったように、アルカリ性の正体も何らかのイオンだということは想像できますね。
アルカリ性の水溶液
アルカリ性の水溶液にはどんなものがあるか、また、その性質を思い出してみましょう。
強いアルカリ性 弱いアルカリ性 水酸化ナトリウム(NaOH)水溶液
水酸化カリウム(KOH)水溶液
水酸化カルシウム(Ca(OH)2)水溶液 石灰水
炭酸ナトリウム(Na2CO3)水溶液
などアンモニア(NH3)水
アンモニアが水にとけたもの
炭酸水素ナトリウム(NaHCO3)水溶液
溶質はふくらし粉の主成分
など※KOHやCa(OH)2は、中学では覚える必要はありません。共通して「OH」をふくんでいることに注目しましょう。
アンモニアも水にとけて NH3+H2O→NH4++OH- と、弱く電離しています。アルカリ性の水溶液の性質
・皮膚につけるとぬるぬるする
・赤色リトマス紙を青色に変える
・BTB溶液を青色にする
・フェノールフタレイン溶液を赤色にする
・電流を通す※リトマス紙やBTB溶液については、忘れた場合こちらで確認してください。
アルカリの電離
水にとけてアルカリ性を示す化合物を
アルカリといいます。
アルカリは水にとけると、アルカリ→陽イオン+水酸化物イオン
のように電離します。
たとえば水酸化ナトリウムなら NaOH → Na+ + OH- というように、陽イオンはそのアルカリによって決まりますが、共通して水酸化物イオン(OH-)が水溶液中に存在しています。
この水酸化物イオン(OH-)がアルカリの性質を示すものです。※水酸化物イオンがリトマス紙を青くしていたのですね。
|
例題1と同様に考えます。
水酸化ナトリウムは水溶液中でNaOH → Na+ + OH-
と電離します。水酸化ナトリウムはアルカリなので、水溶液中の水酸化物イオン(OH-)が赤色リトマス紙を青く変えるはずです。
電圧をかけると、ナトリウムイオン(Na+)は陰極(-)に、水酸化物イオン(OH-)は陽極(+)に引かれ、移動します。
色が変わるのは陽極側の赤色リトマス紙ですね。
![]()
右の図は例題1・2と同様の装置である。
①中央の細長いろ紙に塩酸をしみこませた場合、
陽極に引かれるイオンは何か。
H+ OH- Na+ Cl-②中央の細長いろ紙に水酸化カリウム水溶液
をしみこませた場合、色が変わるリトマス紙は
A~Dのどれか。
A B C D③中央の細長いろ紙に硫酸をしみこませた場合、
色が変わるリトマス紙はA~Dのどれか。
A B C D
top > イオン > 中和 > アルカリ