|
化学電池…化学変化を利用して電流をとり出す装置
|
電解質の水溶液に2種類の金属(電極)を入れ、
導線でつなぐ
↓
金属のイオンになりやすさの違いによって、
電流をとり出すことができる
|
 |
イオンになりやすいほうの金属→−極となる
イオンになりにくいほうの金属→+極となる
|
電池のしくみ…亜鉛板から銅板に電子が流れる回路ができる(例…ボルタの電池)
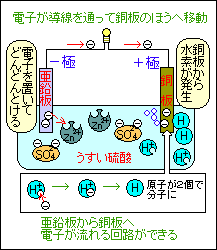 |
うすい硫酸の中に亜鉛板と銅板を入れる
(亜鉛のほうが銅よりイオンになりやすい)
硫酸は水素イオンと硫酸イオンに電離している
電子を電極に残して亜鉛がイオンになる
↓
導線を通って銅板のほうへ電子が移動
(電子が移動した=電流が流れた)
ただし、電子の移動の向きと電流の向きは逆
↓
銅板で水溶液中のH+(水素イオン)に電子を渡す
↓
H+は電子を得てH(水素原子)になる
↓
Hが2個結びついてH2(水素分子)となり、
銅板から水素発生
|
ボルタの電池では、イオン化しやすい亜鉛が先にとけて−極となる
イオンになりやすさ…金属にはイオンになりやすい・なりにくいの傾向がある

【例】銅と亜鉛では亜鉛が−極になる
マグネシウムと亜鉛ではマグネシウムが−極になる
|