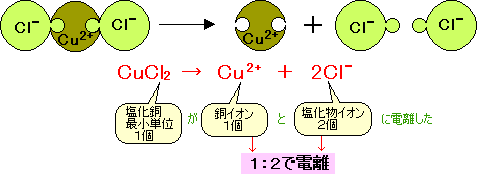
塩化銅を水にとかしたときの、水溶液中の塩化銅の電離のようすを考えてみます。
塩化銅の化学式は CuCl2 なので
電解質の水溶液に電流を流したときの陽極や陰極のようすを考えてみましょう。
塩化銅の電離(参考)
塩化銅を水にとかしたときの、水溶液中の塩化銅の電離のようすを考えてみます。
塩化銅の化学式は CuCl2 なので
塩化銅水溶液の電気分解
塩化銅水溶液に電流を流すとどうなるでしょう。
順番にラジオボタンをクリックしてみてください。
陽極には塩素が発生、陰極には銅が付着して、塩化銅を分解しました。
塩化銅の電離の割合まで覚えなくてもいいですが、物質名・イオン名で結果だけおさえておきましょう。
塩化銅 → 銅イオン + 塩化物イオン ↓
電解質
↓
陽イオンなので
陰極で銅が付着↓
陰イオンなので
陽極で塩素発生電気分解を続けると…?
塩化銅水溶液はきれいな青色をしています。
電気分解を続けると、銅イオンがどんどん銅原子になっていってしまうので、水溶液中の銅イオンが減ります。
一方、塩化物イオンもどんどん塩素として発生してしまうので、水溶液中の塩化物イオンが減ります。
塩化銅水溶液の電気分解を続けていくと
・青色がうすくなる…銅イオンが減るからです。
・電流が流れなくなる…全体のイオンが減るからです。
電気分解のしくみ
電気の+と-は引き合います。電圧をかけると…
陽極(+)⇔陰イオン(-)…陽極に電子(-)をわたして原子になる
陰極(-)⇔陽イオン(+)…陰極から電子(-)を受けとり原子になる
その後、分子で存在する物質の場合、分子をつくって電極から出てきます。だから、
塩素…必ず陽極から発生(塩化物イオンは陰イオンだから)
水素…必ず陰極から発生(水素イオンは陽イオンだから)
金属…必ず陰極に析出(金属イオンはいっぱんに陽イオンだから)銅・鉄など
その電解質が何イオンと何イオンに電離するということがわかれば、カンタンに結果は想像できますね。
|
(1)
電流の流れから見ていきましょう。電源を出た電流は電極Dに入ります。…電極Dは陽極
そして電極Cから出ていきます。…電極Cは陰極
その後電極Bに入ります。…電極Bは陽極
最後に電極Aから出ていきます。…電極Aは陰極
ということで、陽極はBとDですね。(2)
銅イオンは陽イオンなので、陰極に付着します。
銅イオンをふくむのは塩化銅水溶液なので、塩化銅水溶液の陰極ですね。 答えはCの電極。(3)
塩酸中ではH+とCl-に電離しています。発生するのは陽極からは塩素(Cl2)、陰極からは水素(H2)ですね。
また、塩化銅水溶液中では銅イオンとCl-に電離しています。発生するのは陽極から塩素(Cl2)です。
(塩酸の陰極)A…水素 (塩酸の陽極)B…塩素 (塩化銅水溶液の陽極)D…塩素
![]() ※記述式の解答は全角で入力してくださいね。
※記述式の解答は全角で入力してくださいね。
図のような装置をつくって電圧をかけた。Aの電極からは気体が発生し、Bの電極には鉄が付着した。
また、Aの電極の近くに赤インクを1滴落としたら色が消えた。
①電極Bは陰極か陽極か。
②Aの電極に発生した気体は何か。物質名で答えよ。
③ここで使った水溶液の溶質は何か。物質名で答えよ。
top > イオン > 電気分解 > 塩化銅の電気分解