塩化水素を水にとかすと塩酸という水溶液になります。塩酸の中でのイオンの電離のようすを考えてみます。
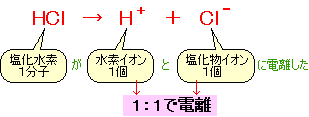
塩化水素の化学式は HCl だから、電離の式は
電解質の水溶液に電流を流したときの陽極や陰極のようすを考えてみましょう。
塩化水素の電離
塩化水素を水にとかすと塩酸という水溶液になります。塩酸の中でのイオンの電離のようすを考えてみます。
塩化水素の化学式は HCl だから、電離の式は
塩酸の電気分解
塩酸に電流を流すとどうなるでしょう。
順番にラジオボタンをクリックしてみてください。
陽極には塩素、陰極には水素が発生して、塩化水素を分解しました。
分解でできた分子の数
塩化水素が塩素と水素に分解される化学反応式を考えてみましょう。
化学反応式のつくり方を忘れてしまった人はこちらへ。
その温度で分子の数が同じとき、気体は同じ体積です(参考)。
水素も塩素も同じ量が発生していると考えられますね。
実際は塩素は水にとけてしまうので、気体を集めると水素のほうが多くなります。
top > イオン > 電気分解 > 塩酸の電気分解