水溶液の濃度を変えないときの、体積とイオンの個数についてつかみましょう。
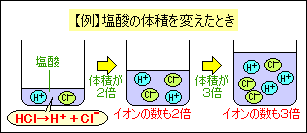
体積が2倍になると、ふくまれるイオンの数も |
 |
たとえば塩酸の体積を2倍にしたときは、中和する水酸化ナトリウム水溶液の体積も2倍にする必要があります。
酸の水素イオンとアルカリの水酸化物イオンは同じ個数で中和します。
実際にはイオンは目に見えないほど小さいので、個数を見て数えることはできませんね。
ここでは、水溶液の体積や濃度からイオンの数を考えます。
濃度を一定にした場合
水溶液の濃度を変えないときの、体積とイオンの個数についてつかみましょう。
濃度が一定
↓
水溶液中にふくまれるイオンの数は
体積に比例する体積が2倍になると、ふくまれるイオンの数も
2倍になります。たとえば塩酸の体積を2倍にしたときは、中和する水酸化ナトリウム水溶液の体積も2倍にする必要があります。
体積を一定にした場合
水溶液の体積を変えずに、濃度(濃さ)を変えたときのイオンの個数についてつかみましょう。
体積が一定
↓
水溶液中にふくまれるイオンの数は
濃度に比例する濃度が2倍になると、ふくまれるイオンの数も
2倍になります。たとえば塩酸の濃度を2倍にしたときは、中和する水酸化ナトリウム水溶液の濃度も2倍にする必要があります。
体積と濃度とイオンの数
いつでも 水素イオンの数=水酸化物イオンの数で中和 します。
体積や濃度がどのように変わっても、イオンの数で考えましょう。
イオンの数は水溶液の体積と濃度に比例します。
体積がχ倍、濃度がy倍になったときのイオンの数…(χ×y )倍
中和する水溶液もイオンの数が(χ×y )倍ふくまれるものを用意すればいいですね。
3×2=6(倍) 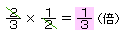
体積がふえて濃度が小さくなりますが、水がふえただけなので、中のイオンの数は変わりません。(意外と盲点)
|
【例題3】 ある濃さの塩酸30cm3とある濃さの水酸化ナトリウム水溶液50cm3をまぜたら完全に中和した。 ①この塩酸60cm3を完全に中和する水酸化ナトリウム水溶液の体積は何cm3か。 |
まず、この濃さの塩酸とこの濃さの水酸化ナトリウム水溶液が完全に中和するときの体積の割合を意識しましょう。
完全に中和するとき、酸とアルカリのイオンの数は同じです。
塩酸30cm3に対して
NaOH水溶液50cm3で中和①
塩酸の体積は2倍になっているので、
中のイオンの数も2倍ですね。
中和するためのNaOH水溶液の体積も
2倍必要です。50(cm3)×2=100(cm3)
答えは100cm3②
塩酸の濃さを2倍にして体積も2倍になっているので、中のイオンの数は
2×2=4(倍) になっています。
中和するためのNaOH水溶液の体積も4倍必要です。50(cm3)×4=200(cm3)
答えは200cm3③
水でどれだけうすめても中のイオンの数はもとのままです。
もとの濃さの塩酸30cm3を中和するNaOH水溶液の体積を考えましょう。答えは50cm3
④
NaOH水溶液の濃さが2分の1になり、体積が2倍になっているので、イオンの数はもとのままです。これを中和する塩酸は30cm3ですから、塩酸30cm3のときに中性です。
まぜた塩酸は30cm3より多い45cm3ですから、液は酸性になります。
top > イオン > 中和 > 濃度と体積