中和を表す式を思い出してみましょう。
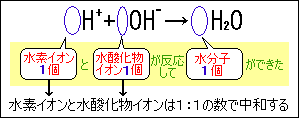
酸の水溶液とアルカリの水溶液をまぜた場合、水素イオンと水酸化物イオンの数が同じときに完全に中和します。
水酸化ナトリウム水溶液にうすい塩酸を少しずつ加えていったとき、ある時点で中和しましたね。
そのとき、水素イオンも水酸化物イオンもなくなり、中性になりました。ここではそれぞれのイオンの数について考えてみましょう。
中和するときのイオンの数の割合
中和を表す式を思い出してみましょう。
酸の水溶液とアルカリの水溶液をまぜた場合、水素イオンと水酸化物イオンの数が同じときに完全に中和します。
イオンの数の変化
中和には4種類のイオンがかかわってきます。
ぞれぞれのイオンの数がどのように変化していくのかを見ていきましょう。
順番にラジオボタンをクリックしてみてください。
それぞれのイオン1種類ずつに注目して数の変化を考えてみましょう。
ナトリウムイオン
(Na+)この場合、NaOH水溶液中にもともと存在していて補給もされてないので、はじめの数から変化ありません。 塩化物イオン
(Cl-)NaOH水溶液にHClが加えられるまで数は0個です。そこからHClが加え続けられるので、数は増えていきます。 水素イオン
(H+)NaOH水溶液中のと反応して中和に使われるので完全に中和するまで0個のままです。
完全に中和してからは数が増え続けます。水酸化物イオン
(OH-)NaOH水溶液に存在していて、加えられると反応して中和に使われていくので、完全に中和されるまで数は減り続けます。
補給がないので、完全に中和してからは0個のままです。※この結果は水酸化ナトリウム水溶液に塩酸を加えた場合のものです。何に何を加えたか意識して考えましょう。
![]()
右図はうすい塩酸に水酸化ナトリウム水溶液を
少しずつ加えていったときのそれぞれのイオンの数を調べていったものである。①アのグラフのイオンは何か。
H+ OH- Na+ Cl-①イのグラフのイオンは何か。
H+ OH- Na+ Cl-①ウのグラフのイオンは何か。
H+ OH- Na+ Cl-①エのグラフのイオンは何か。
H+ OH- Na+ Cl-
top > イオン > 中和 > イオンの数