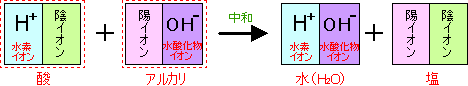
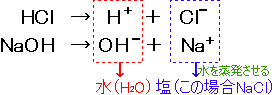例として水酸化ナトリウム水溶液にうすい塩酸をまぜた場合を考えてみましょう。
|
水酸化ナトリウム水溶液に アルカリ性の性質がなくなり、塩化ナトリウム水溶液(食塩水) |
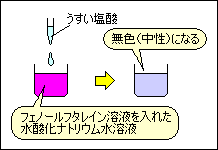 |
アルカリ性がしだいに弱くなって中性になってしまったのは、塩酸中の水素イオン(H+)と水酸化ナトリウム水溶液中の水酸化物イオン(OH-)が結びついて水(H2O)となり、OH-がなくなってしまったからです。
|
中和…水素イオンと水酸化物イオンが結びついて水ができる反応 中和を表す式… H+ + OH- → H2O |
中和のようすをモデルで見ていきましょう。